發(fā)布時間:2024-03-15
近日,中國科學(xué)院廣州生物醫(yī)藥與健康研究院朱強/羅爽課題組通過銅/手性磷酸催化的烯基異腈分子內(nèi)還原(1+2)環(huán)加成反應(yīng),對映選擇性合成了多種含有N-H的2-氮雜雙環(huán)[3.1.0]己烷化合物。相關(guān)研究以“Copper/Chiral Phosphoric-Acid-Catalyzed Intramolecular Reductive Isocyanide-Alkene (1 + 2) Cycloaddition: Enantioselective Construction of 2Azabicyclo[3.1.0]hexanes”為題發(fā)表在《美國化學(xué)會志》(J. Am. Chem. Soc. DOI: 10.1021/jacs.4c00989)上。
2-氮雜雙環(huán)[3.1.0]己烷骨架因其獨特的結(jié)構(gòu)優(yōu)勢,廣泛應(yīng)用在藥物分子、生物活性分子以及有機合成領(lǐng)域,其中三元環(huán)的存在可以降低分子的親脂性以及調(diào)節(jié)N-中心的堿性。目前這類骨架的合成主要方法有Simmons-Smith環(huán)丙烷化、Kulinkovich環(huán)丙烷化、鈀催化分子內(nèi)碳氫活化、以及分子內(nèi)環(huán)異構(gòu)化實現(xiàn)。但這些多數(shù)都集中在其消旋體的構(gòu)建,以及N上通常需要保護。
近年來,Cu-H催化的烯烴的1,2-氫官能化反應(yīng)取得了飛速的發(fā)展,尤其是在對映選擇性氫胺基化領(lǐng)域,Buchwald課題組做了開創(chuàng)性且系統(tǒng)性的工作 (Acc. Chem. Res. 2020,53,1229?1243)。但與此形成鮮明對比的是,Cu-H催化的異腈的1,1-氫官能化反應(yīng)模式相對單一,這主要是由于形成的甲酰亞胺銅中間體是親核性的,只能發(fā)生親核取代和親核加成反應(yīng)。在此前的報道中,一些過渡金屬諸如Ni,Co,很容易與異腈配位形成亞胺金屬絡(luò)合物。在酸性條件下,這類物種更傾向于異構(gòu)形成一類新型的氨基金屬卡賓(Organometallics.,2003,22,2817?2819;Organometallics.,2021,40,968?978),但這類物種活性尚未被廣泛研究。
受此啟發(fā),朱強/羅爽課題組設(shè)計了在銅/手性磷酸催化下,硅烷插入異腈形成的甲酰亞胺銅(I)物種可以有效地異構(gòu)形成α-氨基卡賓銅中間體,從而與分子內(nèi)烯烴發(fā)成(1+2)環(huán)加成反應(yīng)。這種新型的環(huán)丙烷化方法可在空氣和含水條件下進行,并以良好的產(chǎn)率和對映選擇性合成結(jié)構(gòu)多樣化的含N?H的2-氮雜雙環(huán)[3.1.0]己烷化合物。此外,含有兩個手性中心的所有四個立體異構(gòu)體都可以通過外消旋烯基異腈與構(gòu)型相反的手性磷酸從兩個平行動力學(xué)拆分反應(yīng)中對映選擇性的獲得。目前該方法不僅為對映選擇性構(gòu)建2-氮雜雙環(huán)[3.1.0]己烷及其衍生物提供了一種有效的方法,也證明了α-氨基卡賓銅中間體在不對稱合成中的潛力。
廣州健康院朱強研究員、羅爽研究員以及李婧博士為共同通訊作者,廣州健康院2022級博士研究生程思迪為文章第一作者。該項目得到了國家自然基金、廣東省自然科學(xué)基金、廣西自然科學(xué)基金等項目的支持。
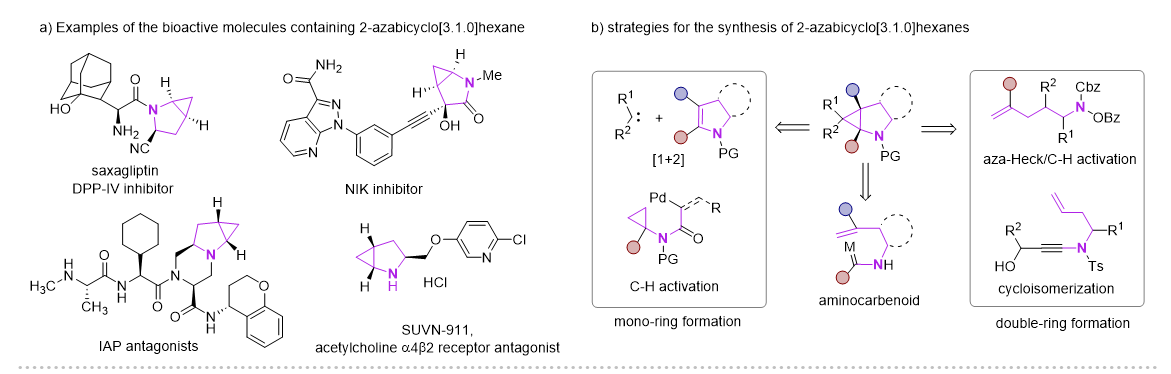
圖1 2-氮雜雙環(huán)[3.1.0]己烷化合物的應(yīng)用及合成方法
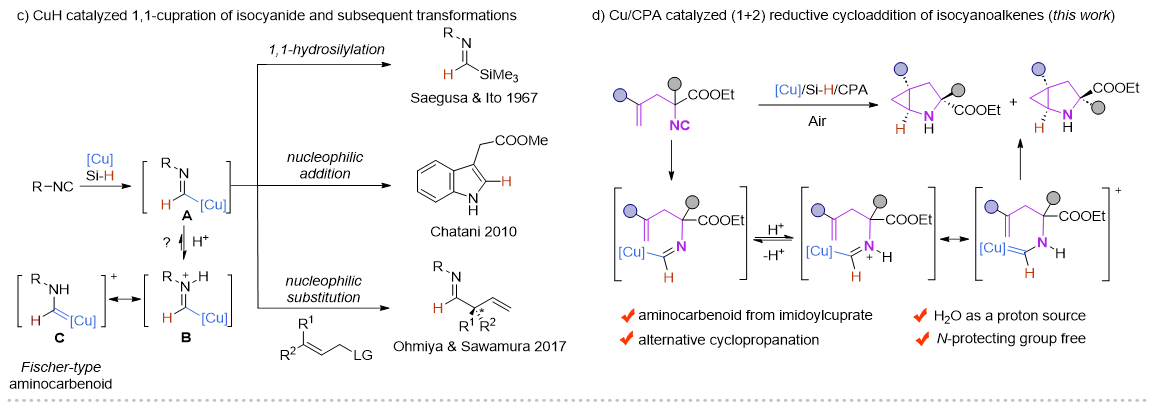
圖2 實驗設(shè)計
附件下載:

