發(fā)布時(shí)間:2024-04-17
盡管譜系節(jié)點(diǎn)細(xì)胞在再生醫(yī)學(xué)中的應(yīng)用前景廣闊,但基于傳統(tǒng)人為操作獲取譜系細(xì)胞單克隆的方法需要消耗大量時(shí)間和勞動(dòng)力,獲取效率通常比較低,且無(wú)法以無(wú)標(biāo)記、無(wú)酶活反應(yīng)參與、非侵入式的方式獲取譜系細(xì)胞單克隆。此外,利用微流控技術(shù)雖然可以提高譜系細(xì)胞收獲效率,但這種方法無(wú)法獲得基于譜系特異性的細(xì)胞單克隆。因此,發(fā)展能夠高效富集譜系細(xì)胞單克隆的自動(dòng)化整機(jī)技術(shù)顯得尤為重要。由于細(xì)胞-細(xì)胞/細(xì)胞-基質(zhì)之間的粘附力變化是譜系細(xì)胞命運(yùn)變化中的一個(gè)關(guān)鍵環(huán)節(jié),通過(guò)調(diào)節(jié)流體剪切力大小可以實(shí)現(xiàn)以無(wú)標(biāo)記、無(wú)酶活反應(yīng)參與、非侵入式的方式分離/選擇具有不同粘附特性的譜系細(xì)胞單克隆,因此這種策略可以應(yīng)用于基于細(xì)胞類(lèi)型特異性的單克隆工程化獲取。
近日,中國(guó)科學(xué)院廣州生物醫(yī)藥與健康研究院(廣州健康院)張驍研究員團(tuán)隊(duì)提出一種基于結(jié)構(gòu)微流體創(chuàng)新的譜系細(xì)胞單克隆自動(dòng)化獲取策略,以無(wú)標(biāo)記、無(wú)酶活反應(yīng)參與、非侵入式的方式,在體細(xì)胞重編程過(guò)程出現(xiàn)的復(fù)雜譜系中實(shí)現(xiàn)了對(duì)特定譜系的單克隆性細(xì)胞的自動(dòng)化獲取,并研發(fā)出基于結(jié)構(gòu)微流體的細(xì)胞單克隆獲取整機(jī)技術(shù)(圖1)。該原創(chuàng)性策略被部署于廣州健康院前期自主研發(fā)的自動(dòng)化干細(xì)胞誘導(dǎo)培養(yǎng)裝備,提高了人誘導(dǎo)多能干細(xì)胞(hiPSCs)單克隆的獲取效率與純度,提升了系統(tǒng)魯棒性(robustness)及縮短了體細(xì)胞重編程后持續(xù)純化hiPSCs(sub-cloning)的建系周期。相關(guān)研究成果以“Selecting Monoclonal Cell Lineages from Somatic Reprogramming Using Robotic-Based Spatial-Restricting Structured Flow”為題在國(guó)際權(quán)威學(xué)術(shù)期刊?Research?上在線(xiàn)發(fā)表。
在研究中,研究人員通過(guò)分析不同體細(xì)胞重編程過(guò)程中細(xì)胞粘附分子的表達(dá)水平變化情況,發(fā)現(xiàn)細(xì)胞多能性基因的表達(dá)水平與Integrin家族基因的表達(dá)量呈負(fù)相關(guān)性,而與Cadherin家族基因的表達(dá)量呈正相關(guān)性。由于Integrins是細(xì)胞與細(xì)胞外基質(zhì)(ECM)相互作用的關(guān)鍵粘附分子,而Cadherins是細(xì)胞與細(xì)胞之間相互連接的重要分子,這意味著體細(xì)胞重編程轉(zhuǎn)變成多能干細(xì)胞這一譜系命運(yùn)變化過(guò)程中,細(xì)胞與ECM的連接可能會(huì)減弱,而細(xì)胞與細(xì)胞之間的連接可能會(huì)增強(qiáng)。為了證明這個(gè)假設(shè),作者提出進(jìn)一步通過(guò)設(shè)計(jì)平行平板流動(dòng)腔實(shí)驗(yàn)和免疫熒光實(shí)驗(yàn)來(lái)進(jìn)行驗(yàn)證。實(shí)驗(yàn)結(jié)果與預(yù)期假設(shè)相一致,并且平行平板流動(dòng)腔實(shí)驗(yàn)初步證明了流體剪切力有望成為分離/選擇特定類(lèi)型粘附細(xì)胞的好技術(shù)路徑。
隨后,作者基于流體動(dòng)力學(xué)原理設(shè)計(jì)了以可以產(chǎn)生局部結(jié)構(gòu)微流體的細(xì)胞獲取微型挑針結(jié)構(gòu)(PTMS),機(jī)械團(tuán)隊(duì)克服了流場(chǎng)效果與多曲面加工實(shí)現(xiàn)的難題,反復(fù)校驗(yàn)加工結(jié)構(gòu),最終基于PTMS產(chǎn)生的結(jié)構(gòu)微流體(PTMS-FLOW)實(shí)現(xiàn)了對(duì)基于空間限位譜系細(xì)胞的特異性挑取。此外,研究證明了PTMS-FLOW可根據(jù)流速變化在Z軸-h0的為常量的條件下,應(yīng)對(duì)不同細(xì)胞類(lèi)型的粘附力差異,實(shí)現(xiàn)以無(wú)標(biāo)記、無(wú)酶活反應(yīng)參與、非侵入式、和非接觸的方式對(duì)不同譜系細(xì)胞進(jìn)行特異性的選擇。該研究證明了結(jié)構(gòu)微流體是作為分離/選擇特定譜系類(lèi)型粘附細(xì)胞的可自動(dòng)化的技術(shù)路徑,為后續(xù)進(jìn)一步研究譜系細(xì)胞單克隆的自動(dòng)化獲取提供了理論基礎(chǔ)(圖2)。
為了將上述策略應(yīng)用于對(duì)體細(xì)胞重編程過(guò)程中特定譜系的細(xì)胞的自動(dòng)化獲取,作者團(tuán)隊(duì)通過(guò)克服機(jī)械模塊控制和精準(zhǔn)調(diào)度的難題,結(jié)合細(xì)胞光學(xué)成像和自適應(yīng)算法,實(shí)現(xiàn)精準(zhǔn)操控微結(jié)構(gòu)的功能底部與細(xì)胞單克隆之間的Z軸間距和水平位移,從而確保精準(zhǔn)操控PTMS-FLOW作用于單克隆性的譜系細(xì)胞上,以此實(shí)現(xiàn)在體細(xì)胞重編程過(guò)程出現(xiàn)的復(fù)雜譜系中快速獲取hiPSCs細(xì)胞單克隆的目標(biāo)。
此外,作者團(tuán)隊(duì)借助自動(dòng)化整機(jī)技術(shù)的精確的流體操控能力,設(shè)計(jì)了一種雙挑模式(Dual?Run?Selection),通過(guò)使用兩次不同強(qiáng)度的剪切流體分別獲取不同類(lèi)型粘附特性的譜系細(xì)胞,實(shí)現(xiàn)了對(duì)特定空間位置的hiPSCs譜系細(xì)胞單克隆的特異性選擇(圖3),并能為下游hiPSCs實(shí)現(xiàn)特異性擴(kuò)增提供純化(sub-cloning)能力。
該研究建立的整機(jī)技術(shù)通過(guò)大幅減少譜系細(xì)胞生成過(guò)程中的時(shí)間成本,以及人工操作量,使得譜系細(xì)胞獲取和培養(yǎng)起來(lái)更簡(jiǎn)單。該研究為自動(dòng)化生產(chǎn)特定譜系細(xì)胞用于臨床干預(yù)提供了新的技術(shù)方案,并為再生醫(yī)學(xué)基礎(chǔ)研究提供更多自動(dòng)化獲取譜系細(xì)胞的工具,從而從技術(shù)手段和方法學(xué)方面促進(jìn)再生醫(yī)學(xué)領(lǐng)域的基礎(chǔ)研究和應(yīng)用落地。
廣州健康院陳學(xué)平博士、樊科高級(jí)工程師、盧俊高級(jí)工程師、張晟博士、董建華高級(jí)工程師及秦季生工程師為該論文的共同第一作者。廣州健康院張驍研究員為該論文的唯一通訊作者。該研究得到了中國(guó)科學(xué)院、廣東省科技計(jì)劃、廣州市科技計(jì)劃等項(xiàng)目的支持。
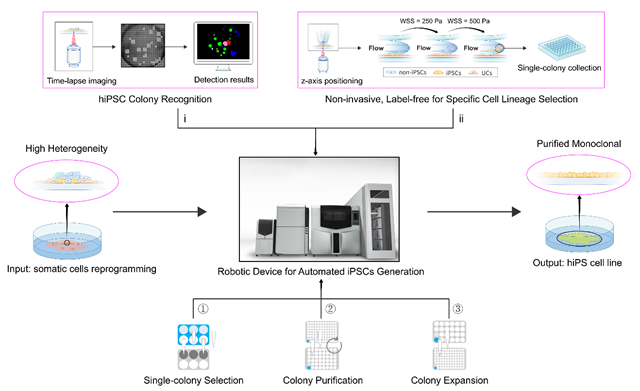
圖1. 譜系細(xì)胞自動(dòng)化獲取策略整機(jī)技術(shù)概要
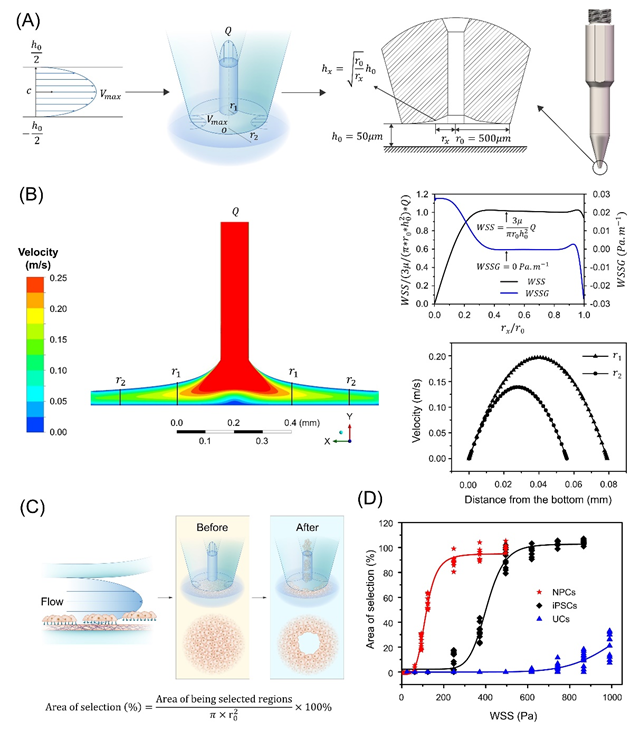
圖2. 基于空間定位的結(jié)構(gòu)微流體研究不同譜系細(xì)胞的粘附分離作用
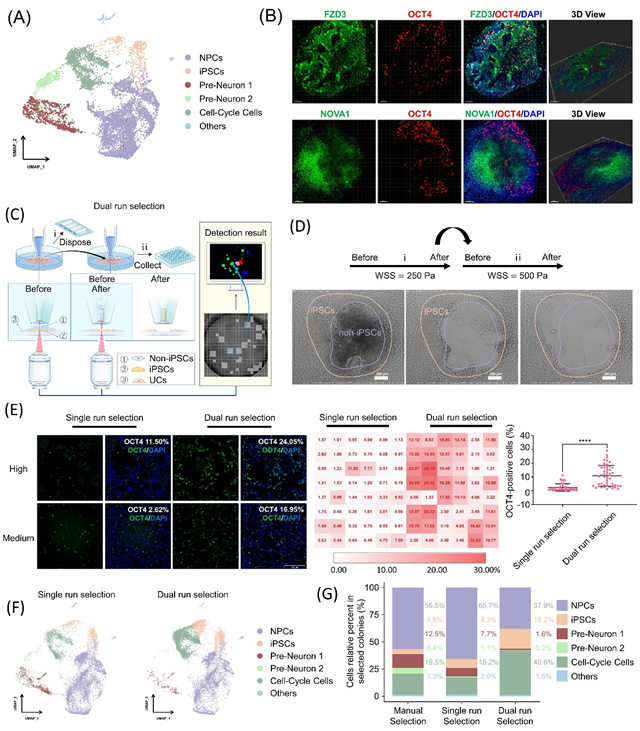
圖3 基于譜系細(xì)胞粘附力的差異,應(yīng)用PTMS-FLOW實(shí)現(xiàn)了對(duì)重編程多能干細(xì)胞單克隆的選擇
附件下載:

