發(fā)布時間:2024-07-27
近日,中國科學院廣州生物醫(yī)藥與健康研究院賴良學/王可品課題組在Signal Transduction and Targeted Therapy雜志上發(fā)表了題為In vivo evaluation of guide-free Cas9-induced safety risks in a pig model的研究論文。該研究發(fā)現(xiàn),Cas9蛋白本身在豬體內(nèi)持續(xù)性表達會導致體內(nèi)基因組損傷、轉(zhuǎn)錄組穩(wěn)態(tài)改變和全基因組突變增加,從而引發(fā)安全風險。
CRISPR/Cas9系統(tǒng)由Cas9蛋白和單鏈導向RNA(sgRNA)組成,因其強大的基因組改造能力而備受關注。CRISPR/Cas9系統(tǒng)已被廣泛應用于基因功能研究、人類疾病模型構建、作物和家畜生產(chǎn)性能改良等。此外,CRISPR/Cas9介導的基因治療已被應用于治療各種遺傳性疾病或其他難治性疾病的臨床試驗中,特別是首款CRISPR/Cas9基因治療藥物的批準上市,標志著CRISPR/Cas9技術已經(jīng)跨越實驗室的門檻,正式步入臨床應用的新紀元。
盡管臨床試驗結果振奮人心,但CRISPR/Cas9介導的基因治療仍存在重大的安全性風險,包括脫靶、基因組損傷和潛在的免疫原性等。sgRNA依賴的脫靶和基因組損傷已引起了廣泛關注,并開發(fā)出多種新型基因編輯方法來減低以上風險的發(fā)生。然而,有報道顯示Cas9蛋白作為外源蛋白,也可以誘發(fā)基因組損傷,激活p53相關通路并富集p53失活突變,引發(fā)CRISPR/Cas9系統(tǒng)臨床應用的額外安全性擔憂。目前,對Cas9蛋白本身導致的安全性風險的評估僅限于體外細胞實驗研究,而對于在體基因治療,亟需在體評估Cas9蛋白導致的安全性風險。
豬在器官大小、解剖結構、生理代謝、免疫系統(tǒng)等方面與人非常相似,被認為是評估基因治療有效性和安全性的理想大動物模型。前期,賴良學課題組培育出了小分子藥物靈活調(diào)控基因剪刀蛋白Cas9表達的工具豬。利用該工具豬,小分子藥物可靈活調(diào)控Cas9蛋白在豬體內(nèi)的表達時間和表達劑量,極大方便了在大動物體內(nèi)評估Cas9蛋白單獨表達導致的安全性風險。
研究人員首先證實,Cas9蛋白在豬體內(nèi)單獨表達會導致體內(nèi)細胞DNA雙鏈斷裂,引起基因組損傷,并且這種損傷程度與Cas9蛋白的表達時間和表達劑量呈正相關。接著,研究人員進一步證實,Cas9蛋白短期(2周)持續(xù)體內(nèi)表達還可導致多器官轉(zhuǎn)錄組穩(wěn)態(tài)改變,包括凋亡、細胞周期阻滯、DNA損傷修復等相關信號通路基因的激活。更為重要的是,隨著Cas9在豬體內(nèi)長期表達(5個月到12個月),模型豬出現(xiàn)了生長遲緩和消化功能障礙等異常表型,全基因組測序分析顯示,長期表達Cas9蛋白的豬體內(nèi)基因組突變數(shù)量顯著增加,并且腫瘤驅(qū)動基因突變數(shù)量同樣高于對照組,表明Cas9蛋白的長期表達不僅影響個體生長發(fā)育,還可能增加腫瘤發(fā)生的風險。
該研究在大動物體內(nèi)系統(tǒng)發(fā)現(xiàn)了Cas9蛋白的上述新安全風險,提示我們在應用CRISPR/Cas9基因編輯技術進行基因治療時,還需要充分考慮來源于Cas9蛋白本身潛在的安全隱患。
中國科學院廣州生物醫(yī)藥與健康研究院葛維凱博士、茍士學博士,趙筱竹博士研究生和金琴副研究員為該論文的共同第一作者,王可品研究員、賴良學研究員和吳涵副研究員為該論文的共同通訊作者。該研究成果得到了國家重點研發(fā)計劃、國家自然科學基金、中國醫(yī)學科學院院外創(chuàng)新單元、海南省重大科技計劃、中國科學院青年創(chuàng)新促進會等項目的資助。
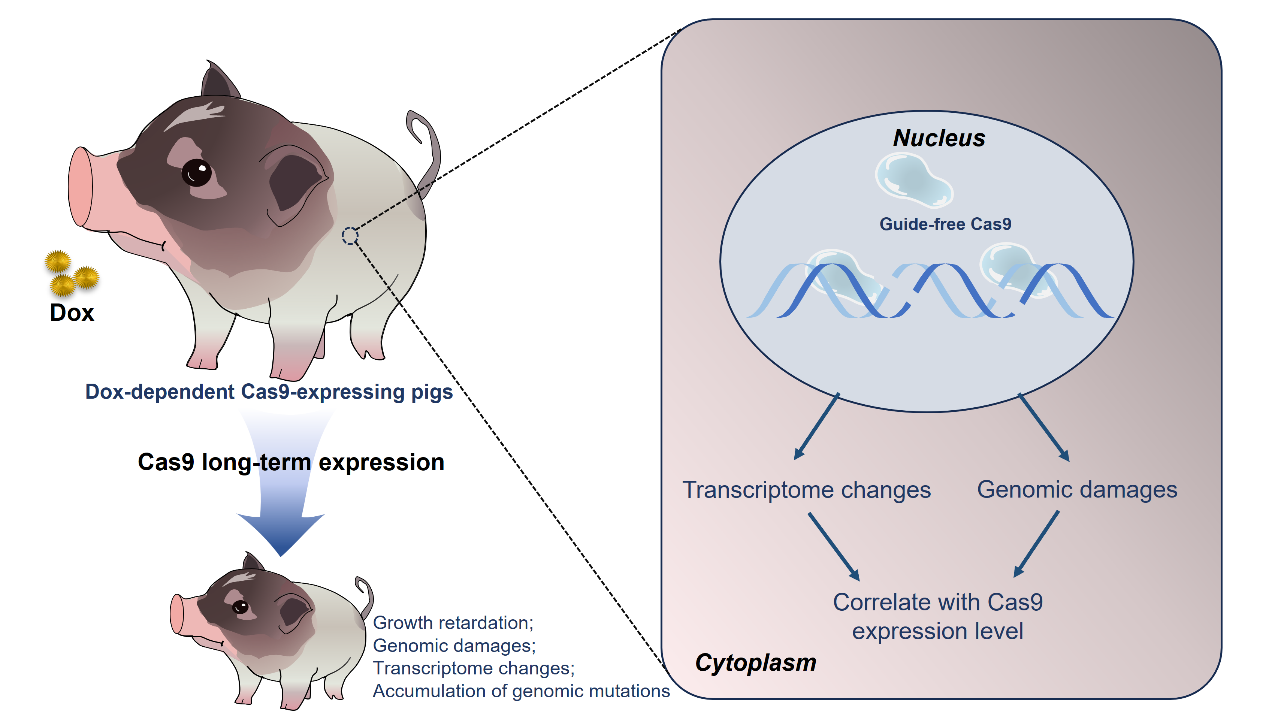
豬體內(nèi)單獨表達Cas9蛋白引發(fā)的安全性風險示意圖
附件下載:

