發(fā)布時間:2023-09-05
近日,中國科學(xué)院廣州生物醫(yī)藥與健康研究院與澳門大學(xué)合作在Cell Research在線發(fā)表題為Structural basis of nucleosome deacetylation and DNA linker tightening by Rpd3S histone deacetylase complex的研究論文。該研究通過生化手段及單顆粒冷凍電鏡技術(shù)確定了Rpd3S組裝模式,并且以多種不同核小體底物模擬Rpd3S去乙酰化過程中的不同狀態(tài),成功捕獲了Rpd3S在H3K36甲基化依賴的去乙酰化過程中的多個構(gòu)象,以及與Linker Histone H1共存的模式。基于以上結(jié)果本研究提出:Rpd3S通過其Eaf3亞基上的CHD識別H3K36me3,并利用Sin3 basic surface與DNA的靜電相互作用作為錨點,以多個不同的模式與核小體底物相結(jié)合,來移除不同區(qū)域組蛋白尾巴賴氨酸的乙酰基;另外,Rpd3S完成去乙酰化功能伴隨著雙側(cè)DNA linker α角度的減小,提示Rpd3S不但可以擦除帶負(fù)電的乙酰基團(tuán),同時也可能以與linker DNA 直接作用的方式來收緊DNA并幫助壓縮染色質(zhì);而與H1的共存模式進(jìn)一步提示了去乙酰化復(fù)合物與連接組蛋協(xié)同凝縮染色質(zhì)的可能性。
在真核細(xì)胞中,組蛋白去乙酰化酶(Histone deacetylation, HDAC)以依賴于上游組蛋白修飾的形式來調(diào)控基因的轉(zhuǎn)錄水平,同時防止隱性轉(zhuǎn)錄的發(fā)生。在釀酒酵母(Saccharomyces cerevisiae)中,組蛋白去乙酰化酶Sin3 HDAC以Rpd3S和Rpd3L兩種多亞基復(fù)合物形式分別存在于基因編碼區(qū)及啟動子區(qū)域。在基因轉(zhuǎn)錄過程中,Set2-Rpd3S通過聯(lián)系組蛋白甲基化狀態(tài)和去乙酰化的進(jìn)程來維持染色質(zhì)的穩(wěn)定性,并防止異常隱性轉(zhuǎn)錄的發(fā)生。在過去的報道中,Rpd3S被認(rèn)為不僅可以對所有四個組蛋白尾巴上的特定賴氨酸乙酰基發(fā)揮作用,并且能同時穩(wěn)定核小體的動態(tài)變化。然而,Rpd3S多位點、多功能性的特點,目前在機(jī)理上并未得到明確的闡釋。
值得一提的是,在7月19日,Nature雜志在線發(fā)表清華大學(xué)李海濤課題組和閆創(chuàng)業(yè)課題組題為Diverse modes of H3K36me3-guided nucleosomal deacetylation by Rpd3S的文章,通過結(jié)構(gòu)和生化手段對Rpd3S在H3/H4 deacetylation構(gòu)象下的分子機(jī)制做了詳盡的探討。本研究對前述H3/H4 deacetylation的工作機(jī)制做了進(jìn)一步的驗證和支持,同時提出了Rpd3S在不同H3K36me3和linker DNA協(xié)作的條件下多個全新的結(jié)合模型,發(fā)現(xiàn)Rpd3S復(fù)合物各亞基的組裝模式以及識別核小體底物的關(guān)鍵氨基酸位點,揭示了Rpd3S通過調(diào)整與核小體的相對位置實現(xiàn)對不同組蛋白去乙酰化的分子機(jī)制;同時,也發(fā)現(xiàn)了Rpd3S完成去乙酰化與Hho1發(fā)生時空伴隨,可能是Rpd3S去乙酰化后移向+1核小體與Hho1協(xié)同參與組裝和壓縮染色質(zhì)并進(jìn)一步沉默基因轉(zhuǎn)錄。
廣州健康院博士生董淑琦、博士后Nadia Rasheed,澳門大學(xué)博士后李華東、博士生王美林為本文共同第一作者,廣州健康院何俊研究員與澳門大學(xué)William Chong Hang Chao教授為共同通訊作者。該研究得到了國家自然科學(xué)基金、中國科學(xué)院啟動基金以及澳門大學(xué)、澳門特別行政區(qū)科學(xué)技術(shù)發(fā)展基金等的資助。
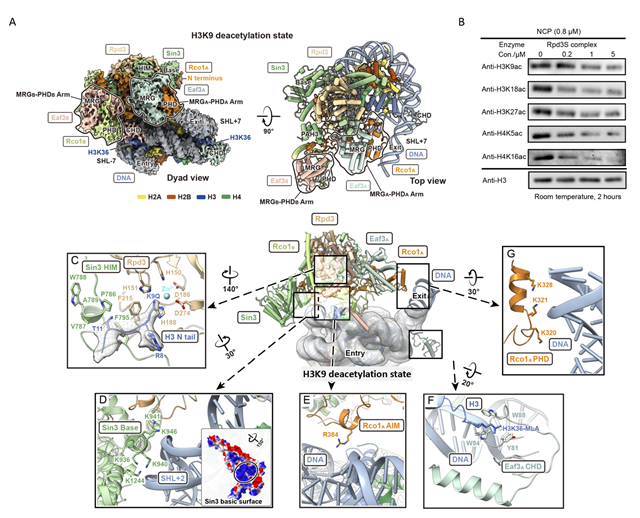
圖1. A:Rpd3S去乙酰化H3K9的cryo-EM電子密度圖及搭建模型圖;B:Rpd3S去乙酰化H3/H4不同賴氨酸殘基的western blotting結(jié)果;C:H3 N端K9Q與Rpd3的酶活中心相互作用圖;D:Sin3 basic surface氨基酸與DNA相互作用圖;E:Rco1 AIM與DNA相互作用圖;F:CHD芳香籠與H3K36me3相互作用圖;G:Rco1 PHD與DNA相互作用圖。
附件下載:

