發(fā)布時間:2024-06-21
2024年6月18日,中國科學(xué)院廣州生物醫(yī)藥與健康研究院唐士兵研究員與浙江大學(xué)楊兵研究員、北京航空航天大學(xué)劉超副教授團隊合作,報道了一種新型氟磺酸類可富集化學(xué)交聯(lián)的非天然氨基酸并在活細(xì)胞中研究蛋白質(zhì)相互作用。相關(guān)成果以“Characterize direct protein interactions with enrichable, cleavable and latent bioreactive unnatural amino acids”為題發(fā)表在學(xué)術(shù)期刊Nature Communications。
蛋白質(zhì)-蛋白質(zhì)相互作用鑒定是蛋白質(zhì)功能研究的重要步驟,在活細(xì)胞中原位鑒定相互作用蛋白對于生物醫(yī)藥研究具有重要意義。基于鄰近觸發(fā)反應(yīng)(proximity-enabled reactivity)的化學(xué)交聯(lián)非天然氨基酸可以捕獲弱作用力和瞬時蛋白質(zhì)相互作用,已被開發(fā)用于原位鑒定活細(xì)胞中的蛋白質(zhì)相互作用。基于質(zhì)譜的交聯(lián)肽段解析能夠提高互作蛋白鑒定的特異性、確定蛋白相互作用界面。然而,由于蛋白質(zhì)樣品和質(zhì)譜數(shù)據(jù)解析過程的復(fù)雜性,對蛋白質(zhì)化學(xué)交聯(lián)后的交聯(lián)產(chǎn)物進行高通量鑒定具有挑戰(zhàn)性。在蛋白質(zhì)樣品進行質(zhì)譜分析前,對交聯(lián)肽段進行富集是提高鑒定效率的有效策略。
在本研究中,研究人員開發(fā)了一種基于化學(xué)基團氟磺酸的化學(xué)交聯(lián)非天然氨基酸,即可富集的氟磺酸-L-酪氨酸(enrichable fluorosulfate-L-tyrosine, eFSY)。利用密碼子擴展技術(shù)可以在蛋白質(zhì)中特定位置插入具有潛在生物反應(yīng)性的非天然氨基酸eFSY,eFSY中氟磺酸通過基于鄰近觸發(fā)反應(yīng)誘導(dǎo)的硫-氟交換 (SuFEx) 點擊反應(yīng)與相互作用蛋白中的酪氨酸、組氨酸或賴氨酸發(fā)生共價交聯(lián)。eFSY攜帶的炔基基團可以通過銅催化疊氮化物-炔環(huán)加成(CuAAC)點擊化學(xué)反應(yīng)鏈接生物素,隨后就能實現(xiàn)交聯(lián)肽段的富集,從而提升鑒定交聯(lián)肽段的效率。此外,該研究發(fā)現(xiàn)氟磺酸基團介導(dǎo)的交聯(lián)產(chǎn)物在質(zhì)譜中的混合性碎裂規(guī)律,其與組氨酸及賴氨酸交聯(lián)產(chǎn)生的磺酸酰胺鍵會在質(zhì)譜中發(fā)生斷裂,與酪氨酸交聯(lián)后形成的磺酸酰胺鍵卻不會斷裂。為更好地應(yīng)用該規(guī)律,該研究進一步開發(fā)了交聯(lián)鑒定軟件AixUaa。AixUaa可同時兼容并區(qū)分碎裂與不可碎裂兩種模式,實現(xiàn)了交聯(lián)肽段及位點的精確匹配,提升了交聯(lián)肽段的鑒定數(shù)量。應(yīng)用此流程,研究人員分別在大腸桿菌及哺乳動物活細(xì)胞中系統(tǒng)性地鑒定了硫氧還蛋白 1 (Trx1) 和硒蛋白 M (SELM)的直接相互作用蛋白組,驗證了該方法的有效性。
總的來說,本研究開發(fā)的基于氟磺酸基團的可富集化學(xué)交聯(lián)非天然氨基酸eFSY及交聯(lián)鑒定軟件AixUaa顯著提升了在活細(xì)胞中鑒定相互作用蛋白中化學(xué)交聯(lián)肽段的效率,克服了以往化學(xué)交聯(lián)劑在鑒定蛋白質(zhì)相互作用蛋白組的一些不足,有望應(yīng)用于更廣泛的蛋白質(zhì)相互作用研究。劉丹丹、丁文龍、程勁韜、韋秋實為本論文的共同第一作者,楊兵、唐士兵和劉超為共同通訊作者。該研究獲得了國家自然科學(xué)基金、國家重點研發(fā)計劃、浙江省自然科學(xué)基金和廣州健康院自主部署基礎(chǔ)研究項目等項目的資助。
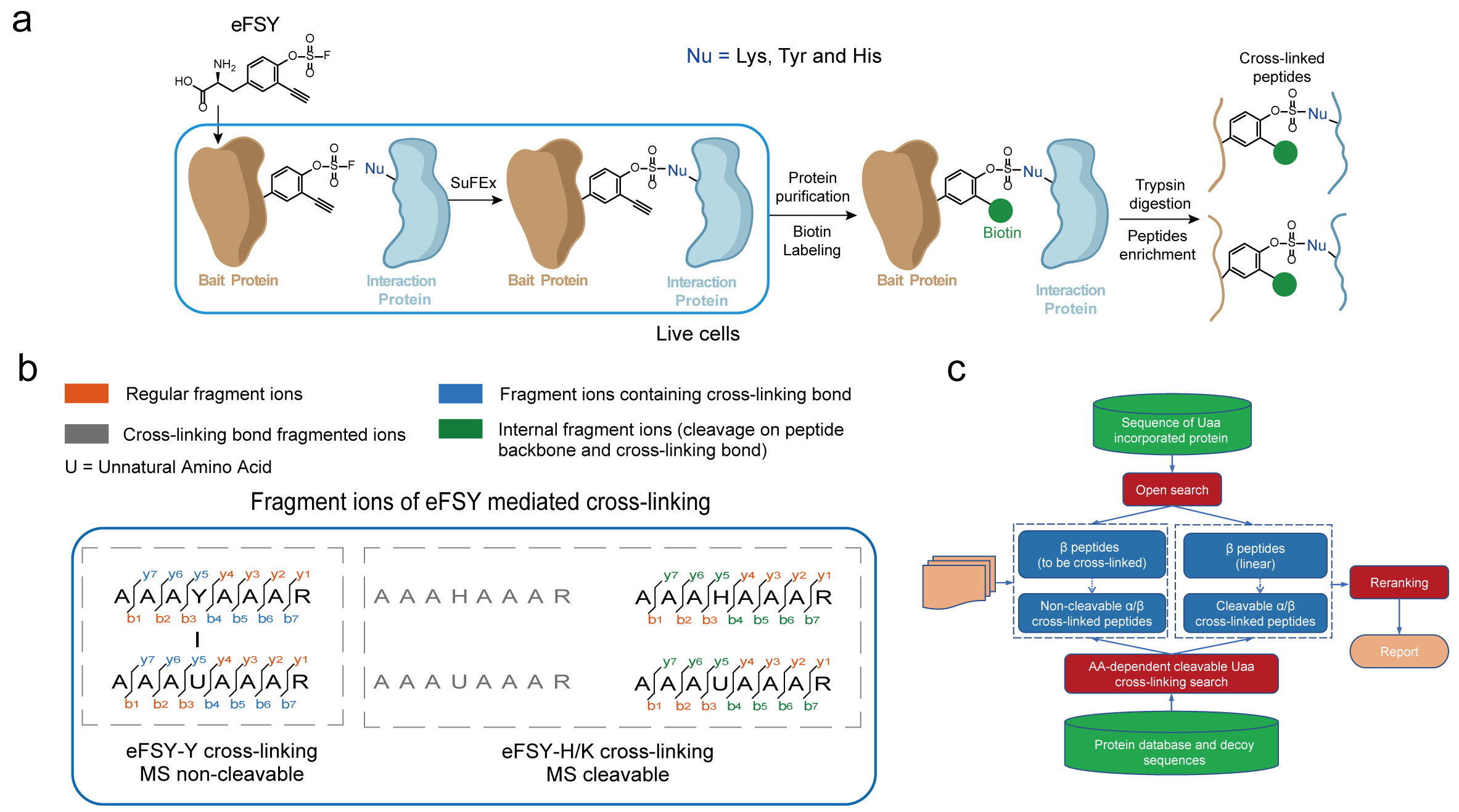
圖1?新型含氟磺酸基團的可富集化學(xué)交聯(lián)劑eFSY研究蛋白質(zhì)相互作用時,鑒定交聯(lián)肽段的流程圖(a),交聯(lián)肽段的碎裂規(guī)律(b)和交聯(lián)鑒定軟件AixUaa的開發(fā)流程(c)
附件下載:

