發(fā)布時間:2024-06-25
中國科學院廣州生物醫(yī)藥與健康研究院研究團隊揭示了分選轉(zhuǎn)運蛋白SNX25通過氧化還原依賴的方式調(diào)控內(nèi)涵體GPCR-G蛋白信號轉(zhuǎn)導的分子機制。相關(guān)研究以“Redox-Modulated SNX25 as a Novel Regulator of GPCR-G Protein Signaling from Endosomes”為題在線發(fā)表于氧化還原領(lǐng)域權(quán)威期刊Redox Biology.
最近十幾年來,越來越多的研究表明,GPCR與G蛋白偶聯(lián)的信號轉(zhuǎn)導不僅可以發(fā)生在細胞質(zhì)膜上,也可以發(fā)生在細胞內(nèi)的內(nèi)涵體上。內(nèi)涵體GPCR-G蛋白信號轉(zhuǎn)導與癌癥、骨骼發(fā)育、神經(jīng)興奮和糖尿病等生理和病理過程密切相關(guān)。RGS蛋白(G蛋白信號轉(zhuǎn)導調(diào)節(jié)因子)能激活Gα亞基的GTP水解酶活性,促進Gα亞基的失活,從而終止G蛋白信號轉(zhuǎn)導。 RGS蛋白對質(zhì)膜上GPCR-G蛋白信號轉(zhuǎn)導的調(diào)控作用被廣泛報道。但內(nèi)涵體上GPCR-G蛋白信號轉(zhuǎn)導的調(diào)控機制,尤其是內(nèi)涵體上G蛋白信號終止的分子機制,仍有待進一步研究。
研究團隊利用免疫沉淀-質(zhì)譜聯(lián)用技術(shù)和熒光共定位等實驗方法,發(fā)現(xiàn)SNX25的PX結(jié)構(gòu)域能結(jié)合一些經(jīng)典的RGS蛋白,包括RGS2、RGS4、RGS8和RGS17。通過結(jié)構(gòu)生物學和細胞生物學實驗,研究團隊發(fā)現(xiàn)SNX25與RGS蛋白的相互作用主要依賴SNX25-PX結(jié)構(gòu)域中C566與RGS蛋白N端半胱氨酸形成的分子間二硫鍵,且該相互作用受氧化還原的調(diào)控。通過熒光共定位實驗,團隊進一步發(fā)現(xiàn)PXA和PXC結(jié)構(gòu)域可以介導SNX25靶向內(nèi)涵體。通過招募經(jīng)典RGS蛋白到內(nèi)涵體,SNX25可以促進內(nèi)涵體上Gαi/q蛋白的失活,最終抑制內(nèi)涵體上GPCR-Gi/q偶聯(lián)的信號轉(zhuǎn)導(圖1)。
此外,團隊還發(fā)現(xiàn)SNX25/RGS復合物不僅可以結(jié)合激活型Gi/q;(GTP結(jié)合態(tài)),也可以結(jié)合失活型Gi/q;(GDP結(jié)合態(tài))。通過將失活型Gi/q;募集到內(nèi)涵體上, SNX25/RGS蛋白復合物還可以抑制質(zhì)膜上GPCR- Gi/q信號轉(zhuǎn)導。
廣州健康院博士后張玉龍和碩士研究生余致君為共同第一作者,徐進新研究員和劉勁松客座研究員為共同通訊作者。該研究獲得了國家自然科學基金面上項目和呼吸疾病全國重點實驗室自主課題等項目的支持。
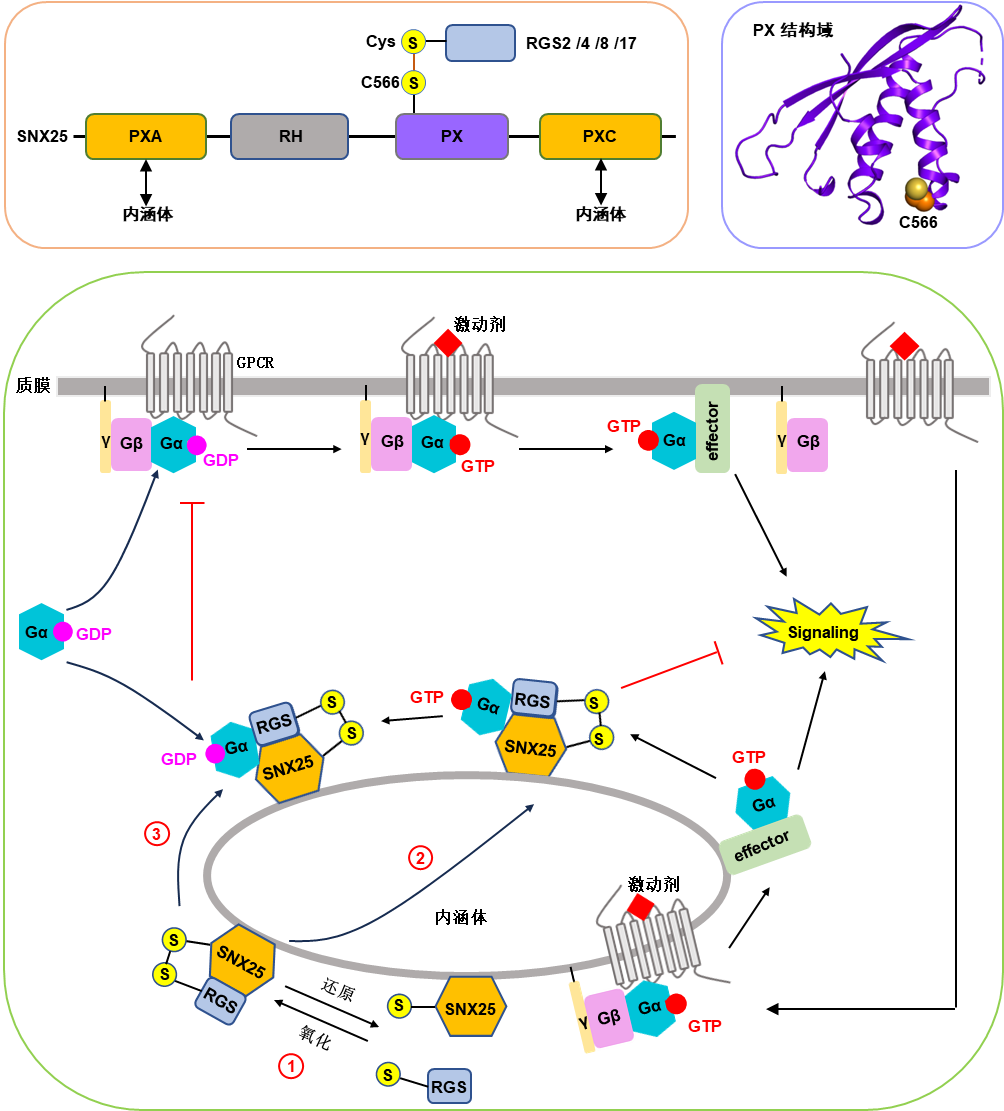
圖1 SNX25調(diào)控GPCR-G蛋白信號轉(zhuǎn)導的分子機制
附件下載:

